
Nanomateriale består av eller inneheld ørsmå partiklar, nemleg nanopartiklar. Desse partiklane er mellom 1 og 100 nanometer store (ein nanometer = ein milliarddels meter).
Nanomateriale kan gjere det mogleg å utvikle sterkare, meir fleksible og meir effektive produkt, og dei siste åra har bruken av nanomateriale auka kraftig. Det kjem mellom anna av at ein kan designe, kombinere og manipulere nanomateriale for å oppnå spesielle eigenskapar ein ønsker seg i eit produkt.
Men så små partiklar kan gå langt ned i lungene om ein pustar dei inn. Korleis kan dette påverke kroppen?
Simulerer eksponering i lungene
Forsking har vist at det kan vere ein samanheng mellom nanopartiklar og negative helseeffektar, som hjarte- og lungesjukdomar og nevrologiske sjukdomar. Difor er det viktig å lære meir om korleis nanopartiklar verkar på cellene i kroppen, og om kor små eller store mengder som er skadelege.
– Å sikre trygg handsaming og bruk av nanomateriale er særleg viktig med tanke på arbeidstakarar som jobbar med slike materiale, og blir eksponerte for nanopartiklar dagleg, seier Laura Maria Azzurra Camassa.
Ho er forskar i arbeidstoksikologi ved STAMI, og leier, saman med Shan Narui, ein ny studie der STAMI og NILU (Norsk institutt for luftforsking) har testa ein 3D-lungemodell til risikovurdering av nanopartiklar.
Lungemodellen er ein biologisk laboratoriecellemodell som simulerer eksponering for nanopartiklar i luftvegane. Han er utvikla for å fungere som eit alternativ til dyrestudiar, i tråd med 3R-initiativet for å redusere (reduce), erstatte (replace) og forbetre (refine) dyreforsøk.
Etterliknar miljøet i alveolane
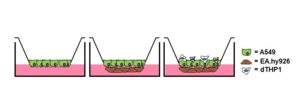
Figur 1. Samanlikning mellom mono-, ko- og trikulturlungemodellar av A549 (epitelceller), EA.hy926 (endotelceller) og differensierte THP1, dTHP1-celler (makrofager), dyrka ved luft-væske-grensesnittet (ALI) på ein porøs membran.
Luftvegane er av særskild interesse fordi dei er «inngangsporten» for flesteparten av partiklane som kjem inn i menneskekroppen.
Ettersom nanopartiklane er så små, kan dei lett bli med lufta vi pustar inn heilt ned i alveolane, som er dei djupaste laga av luftblærer i lungene. Derfrå kan dei passere over i blodet.
– Vi validerer og konstruerer ein lungemodell med tre typar celler, som gjenskaper den alveolære regionen i lungene. I modellen blir cellene dyrka på porøse membranar. Cellene på toppen av membranen er i direkte kontakt med luft på den eine sida og blodkarceller på den andre, forklarer Camassa.
Det gjer at denne lungemodellen skil seg frå tradisjonelle laboratoriemodellar, der ein som regel har brukt cellelinjer som er omgitt av væske.
Eksponert for nanosølv
I studien brukte forskarane både mono-, ko- og tricellekulturar, av høvesvis humane lungeepitelceller, endotelceller og immunceller/makrofager. Slik kunne dei sjå om det å auke kompleksiteten endra kor følsam modellen var.
Lungeeksponeringar blei reproduserte i eit kontrollert skykammer (VITROCELL® skykammer), der nanosølvpartiklar blei aerosoliserte på epitel-/makrofagceller i trikulturen.
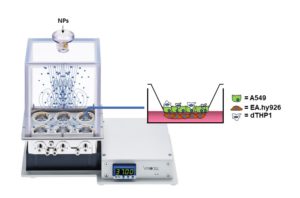
Figur 2. Skjema for lungeeksponering in vitro. Trikulturlungecellemodell i luftvæskegrensesnitt er utsatt for nanopartiklar inne i eit VITROCELL® skykammersystem.
– Modellen synte seg å vere foreinleg med ulike endepunkt. Vi målte både celleskade (cytotoksisitet), skade på DNA (genotoksisitet) og cellulært opptak, seier Camassa.
Kvar eksponerte trikultur kan ein bruke til ulike diagnostiske testar, noko som gir eit fullstendig analytisk bilete av helserisikoen samanlikna med kontroll-trikulturene som ikkje blei eksponerte for nanosølv.
Eit verdifullt verktøy
Eit mål med studien var å teste kor robust og reproduserbar modellen var, ved å samanlikne resultat frå to ulike laboratorium.
– Meir komplekse modellar er meir utfordrande å jobbe med, og vi forventa derfor at auka kompleksitet ville gi større variasjon i funndata mellom laboratoria. Dette viste seg også å bli resultatet, noko som ga oss moglegheita til å optimalisere forskingsprotokollen. Slik får vi sikra at resultata ved framtidig bruk av modellane blir så truverdige som mogleg, seier Camassa.
For neste generasjon av risikovurderingar treng vi modeller som er godt testa, robuste, standardiserte og validerte.
Resultata frå denne studien peiker mot at den avanserte lungemodellen kan bli eit verdifullt verktøy for identifisering og karakterisering av nanomateriale og andre miljøforureiningar i lungene etter innanding.


